بیماری هیرشپرونگ چیست؟
بیماری هیرشپرونگ از اختلالات مربوط به نمو میباشد که مشخصه آن عدم وجود گانگلیونهای عصبی در قسمت انتهایی کولون بوده و سبب انسداد عملکردی میگردد.
به تصویر زیر توجه کنید:
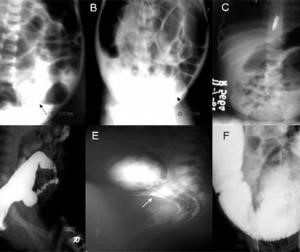
A. عکس رادیوگرافی از مقطعی گذرا از شکم در ناحیه رکتوسیگموئید
B. عکس رادیوگرافی از مقطعی گذرا از شکم در ناحیه میانی سیگموئید
C. عکس رادیوگرافی از مقطعی گذرا از شکم در ناحیه کولون نزولی
D. انما کنتراست گذرا از ناحیه رکتوسیگموئید
E. انما کنتراست گذرا از ناحیه میانی سیگموئید
F. انما کنتراست گذرا از ناحیه کولون نزولی
اغلب موارد بیماری هیرشپرونگ در دوران نوزادی تشخیص داده میشوند. بیماری هیرشپرونگ در نوزادانی که 24 الی 48 ساعت پس از تولد نتوانند مکونیوم را عبور دهند باید در نظر گرفته شود. گرچه کنتراست با انما در تأیید تشخیص مفید میباشد، اما معیار استاندارد هنوز بیوپسی از تمام ضخامت رکتوم میباشد. هنگامی که تشخیص تأیید شود، درمان قطعی برداشت بخش بدون گانگلیون روده و بازگرداندن تداوم روده سالم از طریق اتصال به بخش انتهایی رکتوم. این امر میتواند با یا بدون ایجاد انحراف اولیه در روده انجام گیرد.
پاتوفیزیولوژی بیماری هیرشپرونگ
سه شبکه عصبی به روده عصب رسانی میکنند: شبکه زیرمخاطی(مایسنر)، شبکه ماینتریک(آورباخ) که بین لایههای عضلانی طولی و حلقوی قرار دارد، و شبکه مخاطی کوچکتر. همهی این شبکهها کاملاً یکپارچه بوده و در همهی عملکردهای روده از جمله جذب، ترشح، حرکت و تنظیم جریان خون مشارکت دارند.
حرکات طبیعی به طور اولیه تحت کنترل نورونهای اینترنسیک قرار دارند. در غیاب سیگنالهای اکسترنسیک، روده به لطف معماری بازتابی پیچیده سیستم عصبی انتریک(ENS)همچنان عملکردی کافی خواهد داشت. به همین دلیل به ENS مغز دوم گفته میشود. انقباض و شل شدن عضله صاف روده تحت کنترل گانگلیونهای انتریک قرار دارد. اغلب فعالیت عصبی انتریک به واسطه نیتریک اکسید و دیگر واسطههای عصبی سبب استراحت عضله میشود. اعصاب اکسترنسیک آوران به ENS حاوی فیبرهای کولینرژیک و آدرنرژیک میباشند. فیبرهای کولینرژیک اغلب سبب انقباض میشوند، در حالی که فیبرهای آدرنرژیک اغلب سبب منع انقباض میگردند.
در بیماران مبتلا به هیرشپرونگ، هر دو شبکه ماینتریک و زیرمخاطی وجود ندارند. مقعد همیشه درگیر است و عدم وجود گانگلیون برای فواصل متغیری ادامه مییابد. در غیاب رفلکسهای ENS، کنترل عضله صاف روده عمدتاً بر عهده اعصاب اکسترنسیک است. فعالیت هر دو سیستم کولینرژیک و آدرنرژیک دو الی سه برابر روده طبیعی است. تصور میگردد سیستم کولینرژیک بر سیستم آدرنرژیک غلبه دارد و منجر به افزایش تون عضله صاف میشود. با نبود ایمپالسهای شل کننده اینترنسیک ، تون افزایش یافته عضله برطرف نمیشود. این پدیده منجر به عدم تعادل در انقباض عضله صاف، پریستالسیسم غیرهماهنگ و انسداد عملکردی میشود.
سلولهای گانگلیون انتریک از شیار عصبی در دوران نمو جنینی نشأت میگیرند. در نمو طبیعی، نوروبلاستها در هفته پنجم حاملگی در مری ایجاد میشوند، تا هفته هفتم به روده کوچک و تا هفته دوازدهم به کولون مهاجرت میکنند. یک اتیولوژی احتمالی برای بیماری هیرشپرونگ توقف مهاجرت نوروبلاستهاست. از سوی دیگر گرچه ممکن است مهاجرت طبیعی سلولها رخ دهد، اما نوروبلاستها ممکن است دچار آپوپتوز، ناتوانی در تکثیر یا تمایز نادرست در ناحیه درگیر انتهایی روده شوند. فیبرونکتین، لامینین، مولکول چسبندگی سلول عصبی(NCAM) و فاکتورهای نوروتروفیک در استرومای روده برای نمو طبیعی گانگلیون انتریک ضروری هستند، در حالی که عدم حضور یا اختلال عملکرد میتواند نقشی در اتیولوژی بیماری هیرشپرونگ داشته باشند.
محققان همچنین چندین ژن شناسایی کردهاند که بیان نامناسب آنان میتواند فنوتیپ بیماری هیرشپرونگ را ایجاد کند. مطالعات گسترده ارتباطی ژنومی(GWAS)در اروپاییها و آسیاییها سه واریانت شایع مرتبط با بیماری در RET، SEMA3 و NRG1 شناسایی شدهاند. Rs80227144 یک واریانت کم فرکانس از SEMA3 است که با اروپاییها مرتبط است و یک آنالیز مشروط نشان میدهد که Rs9282834، واریانت بدمعنی(میس سنس)کم فرکانس RET است. Asp489Asn نیز ویژه آسیاییهاست.
پروتوانکوژن RET در چندین مطالعه با پاتوژنز هیرشپرونگ دخیل دانسته شده است.
سو و همکاران وی واریانتهای نادری از RET را کشف کردهاند که با فنوتیپهای شدیدتری در میان بیماران هیرشپرونگ چینی در ارتباط است. لئون و همکاران وی نیز دریافتهاند جهشهای توالی کد گذاری RET در موارد اسپورادیک(موردی)بیماران هیرشپرونگ منجر به برشهایی در پروتئین میشود که از انتقال و اتصال غشا سلولی جلوگیری میکند.
کین و همکارانش تجزیه و تحلیل میکرواری کولون بدون گانگلیون و بافت طبیعی را انجام دادهاند؛ آنان 622 ژن با بیان غیرعادی در بافت بدون گانگلیون و بیان HAND2 میانتریک را که به طور قابل توجهی کاهش یافته است کشف کردهاند.
در مقایسه بیان ژن میان کولون طبیعی و بدون گانگلیون، چن و همکارانش دریافتند بیان بیش از حد ژنهای DLV1 و DLV3 در ارتباط با فنوتیپ هیرشپرونگ هستند.
در نظریهای، بولتر ژادن و همکارانش بیان داشتند جهش در ژنهای RET,GDNF,DFRa1,EDNRB,ET3,ZFHX1B,PHOX2b,SOX10 و SHH در حدود 50 درصد از بیماران هیرشپرونگ وجود دارد.
این مطالعات نشان از پاتوژنز پیچیده بیماری هیرشپرونگ دارند. مطالعات مستمر در مورد عوامل ژنتیکی و محیطی همچنان به توضیح این بیماری مشکل آفرین در آینده ادامه خواهند یافت.
گرچه پاتوژنز اصلی بیماری هیرشپرونگ مربوط به سلولهای گانگلیون انتریک است اما برخی مطالعات حاکی از آناند که سلولهای دیگری نیز میتوانند درگیر باشند. هنگامی که سلولهای عضله صاف در کولون بدون گانگلیون به طور خارجی تحریک میشوند، از نظر الکتریکی غیرفعال هستند. علاوه بر این سلولهای رودهای کاخال(سلولهای ضربان سازی که اعصاب انتریک و عضله صاف روده را به هم وصل میکنند نیز به عنوان یک عامل مهم شناخته شدهاند. این یافته نشان میدهند پاتوفیزیولوژی بیماری هیرشپرونگ تنها به سلولهایی که به طور طبیعی در گانگلیون انتریک قرار دارند محدود نمیشود.
اپیدمیولوژی بیماری هیرشپرونگ
آمار بین المللی
گرچه شیوع بیماری در سراسر جهان نامشخص است، اما مطالعات بین المللی این نرخ را حدود 1 مورد در هر 1500-7000 تولد گزارش کردهاند.
نژاد، جنسیت و آمار جمعیتی مربوط به سن
بیماری هیرشپرونگ تمام نژادها را درگیر میکند؛ با این حال شیوع آن در میان آسیایی-آمریکاییها تقریباً 3 برابر بیشتر است.
این بیماری با نسبت جنسیتی 4 به 1 در مردان شایعتر از زنان است. با این حال نسبت بیماری در طولانی مدت به 2 به 1 کاهش مییابد.
بیماری هیرشپرونگ در نوزادان نارس ناشایع است. سن تشخیص بیماری نسبت به قرن گذشته به تدریج کاهش یافته است. در اوایل قرن 20ام، متوسط سن تشخیص بیماری 2-3 سالگی بود؛ از دهه 50 تا 70 سن متوسط به 2-6 ماه کاهش یافت. هم اکنون، حدود 90 درصد از بیماران هیرشپرونگ در نوزاد تازه متولد شده تشخیص داده میشوند.
پیش آگهی بیماری هیرشپرونگ
گزارشات نتایج دراز مدت پس از اصلاح قطعی بیماری هیرشپرونگ متناقض هستند. برخی پژوهشگران درجه بالایی از رضایت را گزارش میکنند، در حالی که عدهای دیگر شیوع چشمگیر یبوست و بیاختیاری مدفوع را گزارش کردهاند. به طور کلی بیش از 90 درصد بیماران هیرشپرونگ نتایج رضایت بخشی را بیان میدارند. با این حال نیز بسیاری از بیماران اختلالات عملکردی روده را برای چندین سال، قبل از تدام طبیعی تجربه میکنند. حدود 1 درصد از بیماران بیاختیاری ناتوان کنندهای دارند که نیاز به خارج کردن کل کولون(کولوستومی)دارد.
نبودن گانگلیون در کل کولون پیش آگهی ضعیفتری دارد و 33 درصد بیماران به طور مداوم بیاختیاری را تجربه کرده و 14 درصد نیاز به ایلئوستومی دائمی دارند. بیماران با ناهنجاریهای کروموزومی و سندرمهای مرتبط نیز پیش آگهی بالینی ضعیفتری دارند.
عوارض و مرگ و میر
بیماری هیرشپرونگ در حدود 75 درصد از موارد به ناحیه رکتوسیگموئید محدود است. تقریباً 60 درصد از نوزادان مبتلا به بیماری هیرشپرونگ یک بیماری مرتبط از نامحسوس گرفته تا شدید دارند. مشکلات چشمی 43 درصد از نوزادان را درگیر میکند، 20 درصد آنومالیهای مادرزادی مجاری ادراری تناسلی، 5 درصد بیماری مادرزادی قلبی، 5 درصد اختلالات شنوایی و 2 درصد آنومالیهای سیستم عصبی مرکزی را دارند.
بیماری هیرشپرونگ تقریباً در 9 درصد موارد مرتبط با ناهنجاریهای کروموزومی و یا سندرمها میباشد. این بیماری میتواند با سندرمهای زیر مرتبط باشد:
سندرم داون: تظاهرات تریزومی 21 عبارت است از تأخیر در رشد، ویژگیهای مشخصه صورت و درجات مختلف ناتوانی ذهنی.
سندرمهای نوروکریستوپاتی: نوروکریستوپاتیها نشان دهنده طیف وسیعی از اختلالات هستند که ناشی از نمو نابجای شیار عصبی میباشد.
سندرم واردنبرگ شاه: بیماران مبتلا ناهنجاری شنوایی حسی عصبی و هایپوپیگمانتاسیون عنبیه و مو دارند.
سندرم یمنی کور و کر: بیماران مبتلا جهشی در ژن SRY-related HMG-box. تظاهرات بیماری شامل ناهنجاری شدید شنوایی، نیستاگموس، ناهنجاریهای پیگمانتاسیون تکه تکه و ناهنجاریهای عنبیه و قرنیه.
پیبالدیسم: بیماران دچار تکههایی از هایپوپیگمانتاسون ناشی از اختلال مادرزادی در ملانوسیتها هستند. پاتولوژی اصلی در نمو شیار عصبی در بیماری هیرشپرونگ نیز شایع است.
نئوپلازیهای متعدد اندوکرین تیپ 2(MEN2): جهشها در پروتوانکوژن RET با سرطان مدولاری تیروئید در MEN2 و بیماری هیرشپرونگ در ارتباط هستند.
سندرم کاهش تهویه(هایپوونتیلاسیون)مرکزی مادرزادی(CCHS): تظاهر CCHS نبود کنترل اتونوم تهویه است. جهشهای فاکتور رونویسی PHOX2B میتواند با CCHS و هیرشپرونگ در ارتباط باشد.
مگاکولون بدون گانگلیون درمان نشده در نوزادی میتواند مرگ و میری معادل 80 درصد داشته باشد. نرخ مرگ و میر ناشی از هر نوع روش مداخلهای بسیار پایین است. حتی در موارد درمان شده بیماری هیرشپرونگ نیز نرخ مرگ و میر میتواند در نتیجه انتروکولیت شدید نزدیک به 30 درصد باشد.
عوارض احتمالی جراحی عبارتنداز نشت ناشی از آناستوموز(5درصد)تنگی ناشی از آناستوموز(5تا10درصد)انسداد روده(5درصد)آبسه لگن(5درصد) و عفونت زخم(10درصد). عوارض طولانی مدت بیشتر بیمارانی را درگیر میکند که بیماری سگمان بیشتری از کولون آنها را درگیر کرده است.. این موارد عبارتنداز علائم انسدادی مزمن، بیاختیاری مدفوع، یبوست مزمن، انتروکولیت و مرگ ناگهانی.
گرچه بسیاری از بیماران یک یا چند مورد از این مشکلات را تجربه میکنند اما فالوآپهای بلند مدت نشان داده است بیش از 90 درصد کودکان پیشرفت قابل ملاحظهای دارند. بیمارانی که سندرمهای مرتبط داشته و یا بیماری آنان سگمان بیشتری از کولون را درگیر کرده است پیش آگهی ضعیفتری دارند.
عوارض بیماری هیرشپرونگ
عوارض احتمالی جراحیهای پیچیده مرتبط با بیماری هیرشپرونگ طیف تمام عوارض جراحیهای گوارشی را دارا میباشد. به نظر نمیرسد شیوع این عوارض با تجربه جراح تفاوت زیادی داشته باشد.
شایعترین عوارض بعد از عمل شامل انتروکولیت پس از روش Swenson، یبوست پس از روش Dumhel و یبوست و بیاختیاری مدفوع پس از روش Soave.
در کل، شایعترین عوارض عبارتنداز نشتهای آناستوموتیک و ایجاد تنگی در 5 تا 15 درصد، عفونت زخم در 10 درصد، انسداد روده در 5 درصد، آبسه لگن در 5 درصد و نیاز دوباره به جراحی در 5 درصد موارد. پس از انحراف ساختن روده، میتوانند دچار عوارضی از قبیل پرولاپس، فتق یا تنگی شوند.
در یک مطالعه گذشته نگر از سال 1979 تا 2016 که از اطلاعات نموداری 657 بیماری کرهای مبتلا به هیرشپرونگ که تحت عمل جراحی قرار گرفته بودند، حدود 49 بیمار(7.5درصد)نیاز دوباره به جراحی پیدا کردند. دلایل نیاز دوباره به جراحی عبارتنداز مشکلات پاتولوژیک(نبود گانگلیونها، کمبود گانگلیون،سلول گانگلیون نارس) و مشکلات آناتومیک(تنگی، فیستول یا آبسه در آناستوموز)، بیمارانی که مشکلات آناتومیک داشتند بیش از افراد با مشکل پاتولوژیک نیاز به جراحی سوم پیدا کردند.
انتروکولیت، انسداد مزمن، بیاختیاری مدفوع، یبوست و مرگ ناگهانی میتوانند پس از عمل جراحی رخ دهند. فیستولهای رکتووزیکال نیز در مقالات چاپ شده گزارش شده است.
انتروکولیت به عنوان عامل عارضه و مرگ و میر قابل توجه در بیماران هیرشپرونگ شناخته میشود و میتواند پیشرفت کرده و تبدیل به مگاکولون توکسیک شود. مشخصه انتروکولیت التهاب مخاط کولون و روده کوچک است. هرچه بیماری پیشرفت میکند، لومن روده با اگزودای فیبرینی پر میشود و خطر پارگی افزایش مییابد. این پروسه میتواند هم در سگمان بدون گانگلیون و هم دارای گانگلیون کولون رخ دهد. بیماران به طور معمول با اسهال شدید، شکم برآمده، تب، استفراغ و بی حالی و رخوت مراجعه میکنند.
نزدیک به 10 تا 30 درصد بیماران مبتلا به هیرشپرونگ به انتروکولیت دچار میشوند. بیماری با درگیری زیاد سگمان کولون با سیوع افزایش یافته انتروکولیت در ارتباط است. خطر انتروکولیت با اصلاح جراحی کاهش نمییابد.
بیماران ممکن است پس از جراحی با علائم برآمدگی شکم، استفراغ یا یبوست که نشانگر انسداد است مراجعه کنند. انسداد مکانیکی میتواند با آزمایش انمای باریم رکتوم تشخیص داده شود. دیلاتاسیونهای سریالی آنورکتال یا جراحی دوباره ممکن است نیاز باشد.
اگانگلیونوز مداوم در موارد نادر رخ میدهد و میتواند ناشی از اشکال پاتولوژیک، برش نامناسب یا از دست دادن گانگلیون پس از جراحی باشد. اگر بیوپسی از رکتوم سلولهای گانگلیونی را نشان ندهند، باید جراحی دوباره انجام گیرد.
بیماری هیرشپرونگ میتواند با دیگر اختلالات حرکتی روده مرتبط باشد. مطالعه با مواد کنتراست زا، مانومتری و بیوپسی ممکن است برای بررسی دیسپلازی اعصاب رودهای ضروری باشد.
آشالازی اسفنکتر داخلی میتواند منجر به انسداد دائمی شود.این مورد میتواند با برداشت اسفنکتر داخلی، تزریق سم بوتولینوم به اسفنکتر داخلی یا چسب نیتروگلیسیرین درمان شود. اکثر موارد تا 5 سالگی رفع میشوند.
مگاکولون عملکردی میتواند ناشی از نگه داشتن مدفوع توسط بیمار باشد. رژیم کنترل روده میتواند توسط سکوستومی و انمای انتگراد که برای موارد مقاوم است انجام گیرد.
بیاختیاری مدفوع میتواند ناشی از عملکرد غیرطبیعی اسفنکتر، کاهش حس یا سر ریز شدن ثانویه به یبوست باشد. مانومتری آنورکتال و سونوگرافی برای افتراق این موارد مثمر ثمر است.
چه کسانی دچار بیماری هیرشپرونگ میشوند؟
بیماری هیرشپرونگ حدوداً یک در هر 5000 تولد رخ میدهد. کودکان مبتلا به سندرم داون و دیگر ناهنجاریها مانند نقض مادرزادی بیشتر از بقیه نوزادان در معرض خطرند. به عنوان مثال حدود یک در 100 کودک مبتلا به سندرم داون دچار بیماری هیرشپرونگ نیز میباشد.
بیماری هیرشپرونگ مادرزادی است یا هنگام تولد ایجاد میشود. گرچه علائم ممکن است در ابتدای تولد مشخص نباشند. اگر فردی صاحب فرزندی مبتلا به بیماری هیرشپرونگ شود احتمال ابتلای نوزاد بعدی نسبت به افرادی که فرزند سالم دارند بیشتر است. همچنین اگر یکی از والدین مبتلا به هیرشپرونگ باشد، احتمال ابتلای فرزندان نیز افزایش مییابد. فرد باید در این موارد با پزشک خود مشورت کند.
بیماری هیرشپرونگ چگونه درمان میشود؟
بیماری هیرشپرونگ یک عارضه مرگبار است و درمان آن با جراحی میباشد. اکثر کودکانی که تحت عمل جراحی قرار میگیرند اغلب پس از عمل احساس بهبودی دارند. اگر رشد کودک به دلیل هیرشپرونگ پایین بود با انجام جراحی رشد نیر بهبود مییابد.
جهت درمان، جراح کودکان روش pull-through یا اوستومی انجام خواهد داد. در طول هر دو روش، جراح ممکن است همه یا بخشی از کولون را بردارد.
روش pull-through
در این روش، جراح بخشی از روده بزرگ را که فاقد سلولهای گانگلیونی است برداشته و بخش سالم را به مقعد متصل میکند. جراح اغلب این روش را بلافاصله پس از تشخیص انجام میدهد.
جراحی اوستومی
جراحی اوستومی روشی است که در آن مسیر طبیعی دفع مدفوع از بدن را هنگامی که بخشی از کولون برداشته شده است، تغییر میدهند. ایجاد اوستومی به معنای باز کردن راهی برای روده به منظور اتصال به دیواره شکم است تا مدفوع بدون عبور از مقعد از بدن خارج شود. سوراخی که در شکم قرار دارد و مدفوع از طریق آن خارج میگردد استوما نام دارد.
یک کیسه جمع کننده خارجی قابل تعویض به نام کیسه استومایی به استوما وصل میشود تا مدفوع را جمع کند. کودک یا مراقب وی باید کیسه را چندین مرتبه در روز خالی کند.
گرچه اغلب کودکان مبتلا به هیرشپرونگ نیاز به جراحی استومی ندارند، اما کودک ممکن است تا قبل از قرار گرفتن تحت عمل pull-through نیاز به جراحی استومی داشته باشد تا حال عمومی وی بهتر شود. این عمل به نواحی ملتهب روده اجازه میدهد تا بهتر شود. در اغلب موارد، استومی موقتی است و ودک نیاز به جراحی ثانویه خواهد داشت تا استومی بسته شده و دوباره به روده متصل گردد. اما گاهی کودکان مبتلا به بیماری هیرشپرونگ استومی دائمی دارند به خصوص در مواردی که سگمان زیادی از روده فاقد سلولهای عصبی است یا کودک به طور مکرر دچار التهاب روده میگردد که پزشکان بدان انتروکولیت گویند.
جراحیهای استومی شامل موارد زیر است:
- جراحی ایلئوستومی که در آنجراح روده کوچک را به استوما متصل میکند.
- جراحی کولوستومی که در آن جراح قسمتی از روده بزرگ را به استوما متصل میکند.
